|
Artículo Científico / Scientific Paper |
|
|
|
|
https://doi.org/10.17163/ings.n27.2022.03 |
|
|
|
pISSN: 1390-650X / eISSN: 1390-860X |
|
|
CARACTERIZACIÓN DE DELUX: DISPOSITIVO DE ESTERILIZACIÓN POR LUZ ULTRAVIOLETA PARA MÁSCARAS PFF2/N95 CONTRA COVID-19 |
||
|
CHARACTERIZATION OF DELUX: ULTRAVIOLET LIGHT
STERILIZATION DEVICE FOR PFF2 / N95 MASKS AGAINST COVID-19 |
||
|
Recibido: 15-11-2021, Recibido tras revisión: 20-12-2021, Aceptado: 26-12-2021, Publicado: 01-01-2022 |
|
Resumen |
Abstract |
|
La Organización Mundial de la Salud (OMS) declaró un estado pandémico de salud pública debido a la transmisión del nuevo coronavirus el 11 de marzo de 2020. La COVID-19, causada por el SARS-CoV-2, tiene un espectro clínico muy amplio, con predominio de desarrollos sintomáticos respiratorios. El papel de los profesionales de salud en la lucha contra la pandemia requiere un equipo de protección personal (EPP). Las máscaras PFF2 / N95 son EPP adecuados para este propósito. Debido a la gran demanda de máscaras PFF2 / N95 para combatir la pandemia, hubo escasez en el mercado. Este trabajo tiene como objetivo caracterizar un dispositivo denominado DELUX para la esterilización por UVC (espectros de luz ultravioleta C) de mascarillas PFF2 / N95, ampliando su tiempo de uso seguro en condiciones de emergencia. La validación fotométrica del dispositivo permitió la verificación del espectro de emisión de las lámparas empleadas en el dispositivo y la medición de la potencia óptica, demostrando la idoneidad de la irradiación con luz UVC, en ciclos de 15 minutos, de forma segura. La validación biológica mostró que DELUX es capaz de desactivar el SARS-CoV-2 presente en la superficie de las mascarillas PFF2 / N95, siendo así eficiente para su esterilización extendiendo el tiempo de utilización de estas mascarillas. |
The World
Health Organization (WHO) has declared a public health pandemic state due to
the transmission of the new coronavirus on March 11th, 2020. COVID-19, that
is caused by SARS-CoV-2, has a very broad clinical spectrum, with
predominantly respiratory symptoms developments. The role of the health
professionals in fighting the pandemic requires the use of Personal
Protective Equipment (PPE). PFF2 / N95 masks are suitable PPEs for this
purpose. Due to the high demand for PFF2 / N95 masks to fight the pandemic,
there was a shortage of this PPE worldwide. This work aims to present a
characterization of the device called DELUX, utilized for UVC (ultraviolet C
light spectra) sterilization of PFF2 / N95 masks, and allowing to extend the
time of safe use of this PPE in emergency conditions. The photometric
validation of the device resulted in the verification of the emission
spectrum of the lamps used in the device, and the measurement of the optical
power, demonstrating the adequacy of irradiation with UVC light, with a
15-minute cycle, and safely. Biological validation showed that DELUX is
capable of inactivating SARS-CoV-2 present on the surface of PFF2 / N95 masks,
thus being efficient for their sterilization. The safety offered by the
sterilization cycle allows to extend the safe use of those masks. |
|
|
|
|
Palabras clave: COVID-19, equipo, esterilización, protección, radiación, ultravioleta |
Keywords: COVID-19, equipment, protective, radiation,
sterilization, ultraviolet |
|
1,*CECS, Federal University of ABC, UFABC, Brazil. Autor para correspondencia ✉: christiane.lombello@ufabc.edu.br. 2ABC Medical School, FMABC, Brazil
Forma sugerida de citación: Lombello, C. B.; Ali Daghastanli, N:; Windisch Neto, H.; Affonso Fonseca, F. L.; Nogueira Ambrosio, F.; Arbex, R.; Kobb Fernando, I.; Da Silva, V. A.; Pataquini dos Santos, L. y Aparecida da Ana, P. “Caracterización de DELUX: Dispositivo de esterilización por luz ultravioleta para máscaras PFF2/N95 contra COVID-19,” Ingenius, Revista de Ciencia y Tecnología, N.◦ 27, pp. 23-31, 2022. doi: https://doi.org/10.17163/ings.n27.2022.03. |
|
1. Introducción
Los virus conocidos como coronavirus pertenecen al orden Nidovirales, familia Coronaviridae, subfamilia Coronavirinae, género Coronavirus (CoVs) [1]. Fueron identificados inicialmente durante la década de 1930 en aves, y muchos de ellos han sido asociados con enfermedades respiratorias, gastrointestinales, hepáticas y neurológicas en animales. Se conoce que algunos coronavirus causan enfermedades en humanos [2], de los cuales cuatro especies (229E, OC43, NL63 y HUK1) usualmente presentan síntomas de un resfriado común en humanos, y solo en raras ocasiones pueden resultar en una infección severa del tracto respiratorio inferior, como neumonía. Estos casos son particularmente importantes en niños, ancianos y pacientes inmunodeprimidos [3–5]. Sin embargo, otras tres especies consideradas zoonosis (SARS-CoV, MERS-CoV y SARS-CoV-2) están asociadas con infecciones respiratorias más graves en humanos, y pueden ser fatales [3, 4]. SARS-CoV fue identificado en 2002 como la causa del síndrome respiratorio agudo grave (SARS, Severe Acute Respiratory Syndrome), mientras que MERS-CoV fue identificado en 2012 como la causa del síndrome respiratorio de Oriente Medio (MERS, Middle Eastern Respiratory Syndrome) [4]. Más recientemente, SARS-CoV-2 (Figura 1), conocido como el nuevo coronavirus, fue detectado por primera vez en diciembre de 2019 en la ciudad de Wuhan (China), e identificado como el agente etiológico de la enfermedad capaz de agravar el sistema respiratorio [3], [6], con un impacto importante en la salud pública mundial debido a la consecuente morbilidad y mortalidad global [7, 8]. La Organización Mundial de la Salud (OMS) decidió llamar COVID-19 a la enfermedad por coronavirus (acrónimo del inglés coronavirus disease). El 11 de marzo de 2020, la OMS declaró el estado de pandemia en la salud pública, debido a la transmisión del nuevo coronavirus [9, 10]. La enfermedad COVID-19, causada por el SARSCoV-2, tiene un espectro clínico muy amplio. Existen variaciones asintomáticas o distintos síntomas clínicos, tales como garganta irritada, diarrea, anosmia o hiposmia, mialgia, cansancio, fatiga; también se reportaron manifestaciones en la piel, como dermatosis y urticaria [8], [11, 12]. Sin embargo, principalmente los síntomas respiratorios como tos seca y dificultad para respirar, asociados con fiebre, y otros síntomas mencionados están directamente relacionados con las altas tasas de hospitalización y muerte resultantes de la enfermedad [8], [12]. El trabajo de los profesionales de la salud es fundamental para el combate contra la infección, en la prevención, detección, tratamiento y recuperación del |
paciente, y estos esfuerzos profesionales son reconocidos mundialmente [13]. Durante las actividades profesionales, el uso de equipo de protección personal (EPP) puede proporcionar seguridad, previniendo accidentes o enfermedades ocupacionales. La Agencia Nacional de Vigilancia Sanitaria (Agência Nacional de Vigilância Sanitária, Anvisa) de Brasil ha establecido que el EPP requerido durante las actividades realizadas por profesionales de la salud con posible exposición al SARS-CoV-2 incluye gorro, lentes protectores o protector facial, máscara de protección quirúrgica o respiratoria, bata manga larga y guantes [14].
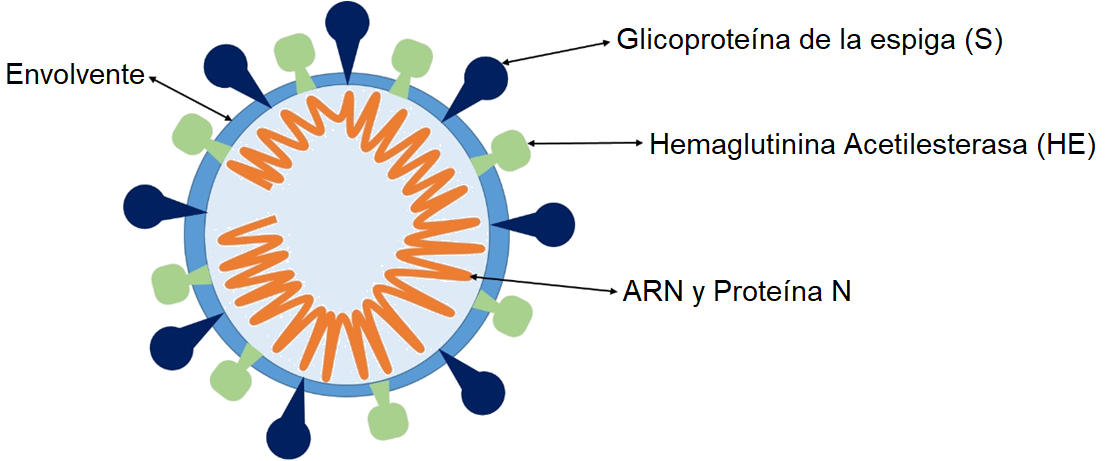
Figura 1. Estructura del coronavirus. Se representan la envolvente, las proteínas de la cubierta (S y HE), la proteína N y el ARN viral
Dado que esta enfermedad es transmitida principalmente a través del aire, las máscaras son un EPP esencial para controlar su propagación. Estos dispositivos también se denominan equipos de protección respiratoria (EPR). Las máscaras quirúrgicas están indicadas para prevenir la contaminación de las vías respiratorias de los profesionales con gotitas respiratorias (partículas mayores a 5 μm) cuando están a menos de un metro del paciente. Sin embargo, no todas las máscaras protegen contra los aerosoles [14,15]. A pesar de que estos cubrebocas, al igual que los de tela, no son consideradas EPP por Anvisa, su uso por parte de la población era obligatorio en muchos países, como Brasil, para contener la transmisión del COVID-19. En los servicios de salud, las mascarillas deben ser utilizadas por pacientes asintomáticos, visitantes, compañeros y profesionales en las áreas administrativas, quienes no tienen contacto con pacientes a distancias menores a un metro [14], [16]. Las máscaras conocidas como piezas de filtrado facial de media cara (PFF) son EPP con una eficiencia mínima de 95 % en el filtrado de partículas de hasta 0,3 μm. En Brasil los tapabocas se clasifican de acuerdo con el nivel de penetración y la resistencia a la respiración, en PFF1, PFF2 y PFF3. Para obtener protección contra aerosoles (esto es, partículas más pequeñas que las gotitas) que contengan agentes biológicos se requieren máscaras PFF2, equivalentes a la máscara N95 adoptada en los Estados Unidos [14], [16–18]. |
|
Estos EPR deben ser empleados por profesionales de la salud que trabajen en procedimientos donde exista el riesgo de generación de aerosoles, tales como recolección de secreciones nasotraqueales, broncoscopias, ventilación no invasiva, ventilación manual antes de la intubación, intubación o aspiración traqueal, y resucitación cardiopulmonar. Adicionalmente, también se recomiendan estos EPR para profesionales de apoyo que llevan a cabo sus actividades en áreas donde se realizan procedimientos que generan aerosoles [14], [16]. Sin embargo, en casos de uso prolongado, es importante que este equipo permanezca ajustado a la cara, y funcional. En este contexto, el Instituto Brasileño para la Seguridad del Paciente (IBSP) advierte que estas máscaras se mantienen efectivas cuando se utilizan hasta ocho horas consecutivas [19]. Las máscaras PFF2/N95 están formadas por capas superpuestas de polipropileno de tela no tejida (TNT), que filtran el aire y atrapan partículas en el orden de 0,3 μm, incluyendo microorganismos tales como el virus SARS-CoV-2 [20]. El impacto de la pandemia de COVID-19 en los servicios de salud incluyó la alta demanda de los EPP utilizados por profesionales de la salud en el combate del coronavirus, lo que trajo como consecuencia una escasez en el suministro de este equipo. A pesar de que no es lo ideal, la falta de disponibilidad de máscaras PFF2/N95 en los mercados hacen necesario su reúso. Anvisa establece que los cubrebocas de protección respiratoria pueden servir más de lo previsto por el fabricante, en situaciones excepcionales. Sin embargo, el reúso de estos EPP por un período de tiempo más allá del considerado como seguro, expone a los profesionales de la salud a la contaminación por el virus, debido a las condiciones de uso, manejo y almacenamiento prolongado. La Nota Técnica GVIMS/GGTES/ANVISA N. 04/2020 [16] describe algunas recomendaciones de la Avisa para emplear apropiadamente este EPP. El reprocesado de un EPP, que está regularizado por la Avisa como desechable, debe garantizar que es seguro como un EPP nuevo, además de no afectar sus características de desempeño. Posibles protocolos de reprocesamiento deben ser validados para garantizar la esterilización del producto, así como también su integridad y funcionalidad [16]. Entre las alternativas desarrolladas para garantizar la seguridad en la extensión de la vida útil y la reutilización de estas máscaras, la esterilización de estos EPP con radiación UVC ha mostrado ser prometedora. Esta técnica, además de rehabilitar su empleo rápidamente, no requiere una gran infraestructura ni espacios elaborados, así como tampoco el reemplazo frecuente de suministros. Por lo tanto, la utilización de un dispositivo de esterilización con tal funcionalidad garantiza una |
posibilidad versátil de que, en principio, los trabajadores de la salud puedan esterilizar su EPP de manera segura y rápidamente [21]. Este artículo tiene como objetivo caracterizar un equipo de bajo costo y producción rápida, desarrollada en la región ABC de São Paulo, para la esterilización de máscaras PFF2/N95, con el propósito de extender el tiempo de uso de este EPP en condiciones de emergencia de escasez en el mercado debido a la pandemia actual de COVID-19.
2. Materiales y métodos
2.1. Emisión de lámparas UVC
La caracterización del espectro de emisión de las lámparas UVC (PURITEC 15W, Osram, Brasil) utilizadas en el dispositivo DELUX fue realizada empleando tres dispositivos diferentes.
2.1.1. Espectrofotómetro ultravioleta (UV-Vis) (Cary 50, Varian)
Se hicieron mediciones para obtener el espectro de emisión de las lámparas UVC (PURITEC 15W, Osram, Brasil).
2.1.2. Espectrómetro OCEAN OPTICS (UV-VIS-NIR spectrometer)
Este espectrómetro está acoplado a una fibra óptica
2.1.3. Medidor de potencia óptica FieldMaxII-TO (Coherent-USA)
El medidor de potencia se acopló al sensor PM-10 (Coherent-USA) para establecer los valores de potencia por área (mW/cm2) a través del sensor semiconductor PM10 en la región espectral deseada.
2.2. Pruebas biológicas
La validación de la eficacia fue realizada juntamente con la Facultad de Medicina ABC (FMABC). Para asegurar la correcta esterilización de la máscara PFF2/N95 a través del sistema DELUX, se propuso una metodología para evaluar la efectividad contra la presencia de virus luego del ciclo de esterilización. Para este estudio, los virus fueron detectados utilizando RTPCR (reacción en cadena de la polimerasa) [22, 23]. |
|
Se usaron tres máscaras N95 del mismo tipo de las empleadas por profesionales de la salud durante sus actividades diarias (en particular el respirador para riesgos biológicos 8801H 9 PFF-2, marca 3M®, Brasil). Una muestra de control con el virus SARS-CoV-2 fue considerada para imitar la contaminación frontal de la máscara, siguiendo procedimientos experimentales. Inicialmente, un hisopo que contenía una muestra viral sirvió para dispersar el contenido de abajo arriba y de izquierda a derecha. El hisopo se utilizó seis veces para dispersar el contenido en las direcciones anteriores en cada una de las máscaras, que luego se dejaron reposar a temperatura ambiente durante tres minutos, en un gabinete de bioseguridad. Posteriormente, las máscaras fueron colocadas en el dispositivo DELUX para maximizar su iluminación completa con luz UVC. La irradiación se hizo en un único ciclo de 15 minutos. Luego de la irradiación, se recolectaron las muestras. Para este propósito, las máscaras se mantuvieron durante un minuto en un gabinete de bioseguridad, y se tomó un hisopo estéril para frotar la superficie de la máscara en la región anterior de abajo a arriba y de izquierda a derecha; este proceso fue repetido seis veces. El hisopo fue colocado en una solución de extracción para obtener el ARN viral. La extracción y amplificación del ARN se hizo siguiendo el protocolo de los Centros para el Control y Prevención de Enfermedades (CDC, Centers for Disease Control and Prevention).
3. Resultados y discusión
Una de las posibles medidas adoptadas mundialmente para la esterilización de máscaras PFF2/N95 es la esterilización con radiación UVC, un agente físico. La luz ultravioleta está en el espectro electromagnético, y la radiación UVC comprende longitudes de onda entre 190 y 280 nm, ubicadas dentro del espectro de la luz UV (espectro electromagnético entre 100 y 390 nm). Sin embargo, las longitudes de onda por debajo de 200 nm no tienen importancia biológica, ya que son absorbidas intensamente por el aire [24]. Las lámparas de radiación UVC utilizadas para acciones germicidas usualmente tienen su emisión pico a una longitud de onda de 254 nm. Este parámetro es adecuado para la desactivación de varios microorganismos, incluyendo coronavirus, tal como se estableció en estudios previos con SARS-CoV y MERS-CoV [25,26]. |
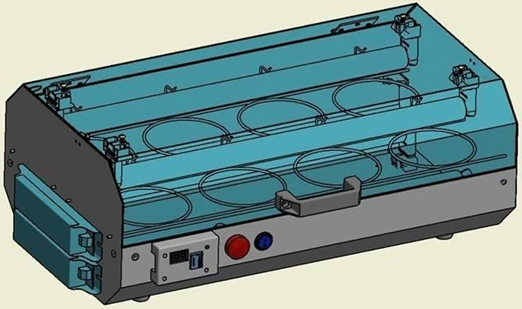
El efecto fotolítico de la radiación UVC es capaz de destruir o inactivar los microorganismos, evitando que se multipliquen. Este efecto es absorbido intensamente por ácidos nucleicos y proteínas, causando la disrupción de bases de ácidos nucleicos y la desactivación de enzimas. A diferencia de otras técnicas, su acción fotolítica raramente produce subproductos potencialmente peligrosos [27–29]. El dispositivo denominado DELUX (Figura 2) fue desarrollado en alianza con la Facultad de Medicina ABC, FMABC, y con la compañía con sede en la región ABC de São Paulo (llamada Ecosan). Este dispositivo fue fabricado con materiales compatibles con su propósito y uso; principalmente se utilizaron 304 láminas de acero inoxidable, asa de transporte, sistema eléctrico para alimentar cuatro lámparas ultravioletas (PURITEC 15W, Osram, Brasil), sistema automatizado de temporización, indicador LED de activación de la lámpara y sistema de seguridad para evitar la activación de las lámparas con el equipo abierto. El dispositivo permite la ubicación simultánea de hasta 16 máscaras, en nichos que permiten la identificación de cada una. Se validó la eficacia fotométrica del dispositivo y la verificación de la eficacia biológica contra el coronavirus.
(a)
(b) Figura 2. DELUX. (a) prototipo, (b) dispositivo |
|
3.1. Medidas fotométricas
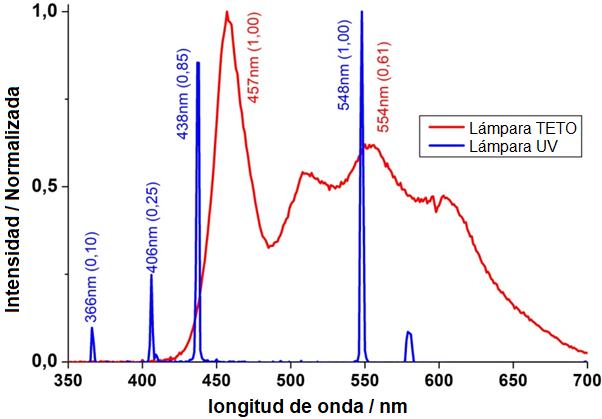
La luz ultravioleta (UV) es la parte del espectro electromagnético caracterizada por longitudes de onda (λ) más pequeñas que las del espectro de la luz visible (VIS), que varía entre 400 nm y 800 nm. El rango espectral de la luz UV está entre 100 y 400 nm, y dividido en tres regiones diferentes: UVA (onda larga) entre 315 y 400 nm; UVB (onda media) entre 280 y 315 nm, y UVC (onda corta) entre 100 y 280 nm [24]. La luz UVC tiene un efecto germicida en comparación con la luz visible [24], [28, 29]. Con respecto a la seguridad, la exposición a UVC puede causar varios efectos biológicos adversos, tales como inflamación aguda de tejidos humanos, conjuntivitis, eritema y, adicionalmente, está asociada a alteraciones cromosómicas que incluso pueden causar algunos tipos de cáncer [24]. Por lo tanto, la luz UV debe usarse cuidadosamente para prevenir posibles efectos adversos. Los efectos biológicos de la acción de la luz UV pueden evaluarse en función del daño a través del parámetro de efectividad espectral relativa, S(λ), por lo que hay que ser cuidadosos cuando ocurre una exposición a luz UV [24], [26], [28, 29]. Las mediciones de la potencia óptica de las lámparas utilizadas en el prototipo DELUX se iniciaron con la caracterización fotométrica de las PURITEC 15W, (Osram, Brasil), midiendo el espectro de emisión en la región UV-VIS (espectrofotómetro Varian), como se muestra en la Figura 3. Se observaron los picos de emisión típicos a longitudes de onda específicas.
(a)
(b) Figura 3. (a) Montaje experimental con la sonda de luz (Ocean Optics). (b) Espectro de emisión de una lámpara de luz blanca (lámpara TETO) y luz UVC (lámpara UV). Picos de emisión en la región de interés, por debajo de 400 nm Las mediciones de las intensidades de las emisiones de potencia fueron complementadas con el medidor de potencia óptica. Las mediciones de la potencia emitida por la lámpara UVC se realizaron utilizando una emisión pico a |
λ = 256 nm y λ = 438 nm, mostradas en la Figura 4. Estos datos permitieron evaluar la emisión de las lámparas UVC utilizadas en el DELUX a las longitudes de onda (λ) relevantes (Figura 4).
Figura 4. Montaje para medir la potencia de la luz UV emitida por las lámparas UV. Las mediciones fueron hechas con dos sondas de potencia diferentes (coherentes), OP2-VIS y PM10 (para UVC). altura (H), potencia óptica (P)
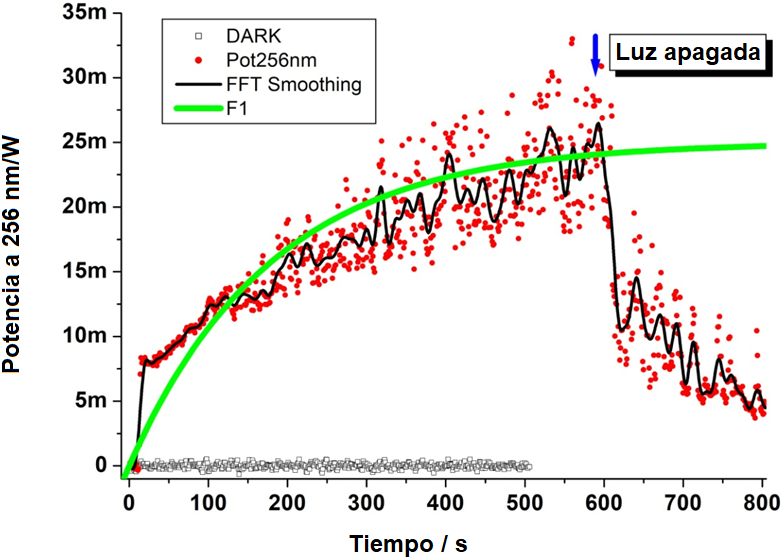
Se hicieron mediciones temporales de la emisión de luz UVC (a 256 nm) desde el momento en que se encendieron las lámparas, a intervalos de 800 s. La Figura 4 muestra la curva cinética de la emisión de la lámpara UV. Se observa que la eficiencia de emisión de potencia de la lámpara se incrementa desde un transitorio de tipo exponencial hasta una emisión constante (Figura 5). Para las mediciones se utilizaron las lámparas UV en el interior del dispositivo, y se verificó una posible fuga de luz hacia el exterior del mismo. El equipo tiene instaladas mantas de caucho que fueron efectivas para bloquear completamente la luz. No se obtuvieron mediciones de potencia de luz fuera del dispositivo, cuando estaba cerrado y encendido, con las lámparas activadas, lo cual es un resultado importante para garantizar la seguridad de los usuarios. Para que la esterilización sea efectiva, deben tomarse en cuenta algunos factores. La dosis (o intensidad) de luz entregada (J/cm2) se determina como el producto de la irradiancia de la fuente de luz (mW/cm2) y el tiempo de irradiación. La dosis de luz debe ser suficiente y adecuada para penetrar el material a ser esterilizado. La penetración de la radiación de luz es controlada por el coeficiente de absorción del material: a menor coeficiente, más exitosa es la aplicación [28, 29].
Figura 5. Curva cinética de la emisión de la lámpara UV. Mediciones temporales. Los puntos rojos son el ajuste monoexponencial de la emisión de luz a 256 nm (10 Hz). La línea negra suaviza los puntos (FFT). La línea verde continua es el ajuste monoexponencial de la data experimental, la emisión de la lámpara UVC alcanza un valor máximo de 25 mW luego de 400 s. Potencia mínima emitida 8 m |
|
La eficiencia de la esterilización también depende de la regularidad y el área expuesta en la superficie del material, ya que existe una dosis mínima de radiación UVC para desactivar los microorganismos [20, 21], [28, 29]. Por lo tanto, una esterilización exitosa ocurrirá solamente si toda la superficie del material está expuesta a la radiación UVC, porque cualquier sombra producida por las capas de tela de las máscaras puede reducir la efectividad de la esterilización. Dado que la superficie requiere luz UV de alta intensidad, las lámparas deben estar cerca del material a ser esterilizado [30]. Según los modelos de mascarillas pueden tener diferentes resultados de esterilización [21]. Las capas extra de protección externa pueden hacer difícil o incluso evitar que la luz UVC penetre hacia las capas más internas. Existen más estudios que permiten la estandarización de este procedimiento, y se recomiendan pruebas individuales para cada tipo de cubrebocas que se utiliza en un lugar en particular [21], [31]. La dosis recomendada de radiación UVC para garantizar una esterilización efectiva es 1 J/cm2. La dosis entre 0,5 y 1,8 J/cm2 fue capaz de desactivar 99,9 % de los patógenos, tales como algunos tipos de Influenza A, MERS-CoV, SARS-CoV y el bacteriófago MS2. La capacidad de filtrado de la máscara se mantuvo aún con dosis altas de radiación UVC [20, 21], [28–31]. El uso de luz UVC es una solución posible para la esterilización de máscaras N95 para su reúso, ya que tiene efectos antimicrobianos y antivirales y no generan residuos tóxicos que pueden permanecer en los tapabocas. La radiación UVC puede promover la degradación del propileno que constituye las capas de filtrado, pero esto es un proceso lento, en el cual dosis menores a 950 J/cm2 no representan ninguna pérdida significativa de eficiencia de filtrado [32, 33].
3.2. Pruebas biológicas
Tras analizar los resultados, todas las muestras fueron clasificadas como «no detectadas». Fue posible concluir que las muestras probadas luego del procedimiento de dispersión del SARS-CoV-2 y enviadas a DELUX presentaron un resultado «no detectado», mostrando que el ciclo de 15 minutos de luz UVC con el dispositivo DELUX fue suficiente para esterilizar las mascarillas. Debido a la alta demanda asociada con dificultades de producción y logísticas, la cantidad de máscaras N95 |
mostró ser limitada e insuficiente para atender a los profesionales de la salud durante la situación de pandemia [34, 35]. Anvisa determina que, debido a las situaciones de emergencia de salud pública, estas máscaras pueden ser excepcionalmente utilizadas por períodos de tiempo más largos y por un número mayor de veces que los especificados por el fabricante, lo cual debe hacerse con ciertas precauciones. Estas deben incluir protección EPP, manejo e inspección apropiada antes de cada período de uso [36, 37]. El límite de reúso no está estipulado por Anvisa, por lo cual debe ser recomendado por cada instalación de salud, y se sugiere promover protocolos apropiados relacionados con la reutilización de estos EPP, así como el cuidado de los profesionales de la salud con los EPP. Un estudio de revisión demostró que una dosis de irradiación de 4 J/cm2 resultó en un 3-log (99,9 %) de reducción en la presencia viral, lo cual representa una descontaminación total en modelos utilizando el virus de la influenza [31]. Además de la dosis de irradiación, el tiempo transcurrido después de la contaminación también resultó en un decrecimiento en la presencia de microorganismos, con una reducción de 1 log (90 %) después de 24 horas [31]. Algunos estudios consideran un periodo de 60 segundos de irradiación para la esterilización [38]. Para el virus MERS-CoV, el tiempo apropiado fue cinco minutos [26]. Por otra parte, para el virus H1N1, el tiempo apropiado fue quince minutos, y la distancia entre la lámpara UVC y las máscaras fue veinticinco centímetros [39]. El dispositivo DELUX se basa en un ciclo de esterilización de quince minutos, proponiendo un ciclo único por día por máscara. En Brasil, debido a la falta de fondos, muchos centros no tienen espacio o equipos para implementar o desarrollar protocolos asociados a la esterilización con radiación ultravioleta (UVC), y la falta de estos EPP ha sido un problema persistente desde el inicio de la pandemia. Este estudio permitió la caracterización del dispositivo DELUX que puede ser utilizado para esterilizar máscaras PFF2/N95 con radiación UVC, de una forma estandarizada, asegurando la extensión del tiempo de uso de estos EPP de manera segura para profesionales de la salud, como lo muestran las caracterizaciones fotométrica y biológica. Otra ventaja de esta esterilización de máscaras PFF2/N95 incluye la reducción de desechos potencialmente infecciosos generados por la eliminación de una gran cantidad de máscaras utilizadas en la pandemia de COVID-19 [40]. |
|
4. Conclusiones
El dispositivo DELUX se basa en una estrategia de esterilización por luz UVC para irradiar máscaras PFF2/N95 con un ciclo de quince minutos. Es un dispositivo de bajo costo, rápido y efectivo para esterilizar máscaras PFF2/N95, permitiendo su reúso apropiado y seguro para aliviar la escasez de EPP durante la pandemia de COVID-19. Las mediciones fotométricas muestran que el DELUX puede hacer una irradiación adecuada de luz UVC, lo cual resulta en una esterilización eficiente de los cubrebocas. Adicionalmente, las mediciones fotométricas garantizan que es un dispositivo seguro de manejar. La caracterización biológica resultó en una desactivación del virus SARS-CoV-2 en la superficie de las mascarillas.
Agradecimientos
A la UFBAC por el apoyo financiero, al Centro Multiusuario UFABC (CEM UFABC) por el apoyo con los equipos, a la Facultad de Medicina de la ABC (FMABC) por la alianza y validación biológica, y a Ecosan por el desarrollo del dispositivo DELUX.
Referencias [1] S. Payne,
“Family coronaviridae,” Elsevier Public Health Emergency Collection, pp.
149–158, 2017. [Online]. Available: https://dx.doi.org/10.1016/B978-0-12-803109-4.00017-9 [2] J. S. M. Peiris,
“Coronaviruses,” Elsevier Public Health Emergency Collection, pp. 587–593.
[Online]. Available: https://dx.doi.org/10.1016/B978-0-7020-4089-4.00072-X [3] M. D. S.
Cespedes and J. C. R. P. Souza, “Sars-cov-2: A clinical update - ii,” Revista
da Associação Médica Brasileira, vol. 66, no. 4, pp. 547–557. [Online].
Available: https://doi.org/10.1590/1806-9282.66.4.547 [4] M. Pal, G. Berhanu, C. Desalegn, and V. Kandi, “Severe Acute Respiratory Syndrome Coronavirus-2 (SARS-CoV-2): An Update,” Pal M, Berhanu G, Desalegn C, Kandi V. Severe Acute Respiratory Syndrome Coronavirus-2 (SARS-CoV-2): An Update. Cureus. 2020;12(3):e7423. Published 2020 Mar 26. doi:10.7759/cureus.7423, vol. 12, no. 3, p. e7423, 2020. [Online]. Available: https://dx.doi.org/10.7759/cureus.7423
|
[5] D. X. Liu, J. Q.
Liang, and T. S. Fung, “Human coronavirus-229E, -OC43, - NL63, and -HKU1
(Coronaviridae),” Elsevier Public Health Emergency Collection, pp. 428–440.
[Online]. Available: https://dx.doi.org/10.1016/B978-0-12-809633-8.21501-X [6] M. Wang, R. Cao,
L. Zhang, X. Yang, J. Liu, M. Xu, Z. Shi, Z. Hu, W. Zhong, and G. Xiao,
“Remdesivir and chloroquine effectively inhibit the recently emerged novel
coronavirus (2019-nCoV) in vitro,” Cell research, vol. 30, no. 3, pp.
269–271, 2020. [Online]. Available: https://doi.org/10.34172/jrcm.2020.005 [7] S. H. Alfaraj,
J. A. Al-Tawfiq, A. Y. Assiri, N. A. Alzahrani, A. A. Alanazi, and Z. A.
Memish, “Clinical predictors of mortality of Middle East Respiratory Syndrome
Coronavirus (MERS-CoV) infection: A cohort study,” Travel Medicine and
Infectious Disease, vol. 29, pp. 48–50. [Online]. Available: https://doi.org/10.1016/j.tmaid.2019.03.004 [8] L. Piroth, J. Cottenet, A.-S. Mariet, P. Bonniaud, M. Blot, P. Tubert-Bitter, and C. Quantin, “Comparison of the characteristics, morbidity, and mortality of COVID-19 and seasonal influenza: a nationwide, population-based retrospective cohort study,” The Lancet Respiratory Medicine, vol. 9, no. 3, pp. 251–259, 2021. [Online]. Available: https://doi.org/10.1016/S2213-2600(20)30527-0 [9] FIOCRUZ. (2021) Por que a doença causada pelo novo coronavírus
recebeu o nome de Covid-19? Fundação
Oswaldo Cruz. [Online]. Available: https://bit.ly/3pwoiEE [10] J. Zhang, W. Wu, X. Zhao, and W. Zhang, “Recommended psychological crisis intervention response to the 2019 novel coronavirus pneumonia outbreak in China: a model of West China Hospital,” Precision Clinical Medicine, vol. 3, no. 1, pp. 3–8, 02 2020. [Online]. Available: https://doi.org/10.1093/pcmedi/pbaa006 [11] M. Relvas, J. Calvão, R. Oliveira, J. C. Cardoso, and M.
Gonçalo, “Manifestações cutáneas associadas a COVID-19: Uma revisão
narrativa,” Revista Científica da Ordem dos Médicos, vol. 34, no. 2, pp.
128–136, 2021. [Online].
Available: https://doi.org/10.20344/amp.14574 [12] M. C. Grant, L. Geoghegan, M. Arbyn, Z. Mohammed, L. McGuinness, E. L. Clarke, and R. G. Wade, “The prevalence of symptoms in 24,410 adults infected by the novel coronavirus (SARS-CoV-2; COVID-19): A systematic review and meta-analysis of 148 studies from 9 countries,” PLoS One, vol. 15, no. 6, p. e0234765, 2020. [Online]. Available: https://doi.org/10.1371/journal.pone.0234765 |
|
[13] E. A. S. Medeiros, “A luta dos profissionais de sade no enfrentamento da COVID-19,” Acta Paul Enferm., p. 33, 2020. [Online]. Available: http://dx.doi.org/10.37689/acta-ape/2020EDT0003 [14] Secretaria de Vigiláncia em Saúde. (2021) Recomendações de
proteção aos trabalhadores do serviço de saúde no contexto da pandemia da
Covid-19. Ministério da
Saúde, Brasil. [Online]. Available: https://bit.ly/3pvZ3lX [15] C. D. Cappa, S. B. Sima Asadi, A. S. Wexler, N. M. Bouvier, and W. D. Ristenpart, “Expiratory aerosol particle escape from surgical masks due to imperfect sealing,” Scientific Reports, no. 11, p. 12110, 2021. [Online]. Available: https://doi.org/10.1038/s41598-021-91487-7 [16] ANVISA, Nota Técnica GVIMS/GGTES/ANVISA N◦ 04/2020. Orientações para serviços de saúde: medidas de prevenção e controle que devem ser adotadas durante a assistencia aos casos suspeitos ou confirmados de infecção pelo novo coronavirus (SARS-CoV-2). Agéncia Nacional de Vigiláncia Sanitária, 2021. [Online]. Available: https://bit.ly/3z12T9X [17] ABNT, Equipamento de proteção respiratória – Filtros para partículas. Associação Brasileira de Normas Técnicas (ABNT), 2010. [Online]. Available: https://bit.ly/3qwTiUF [18] ——, Equipamento de proteção respiratória – Peça semifacial filtrante para partículas. Associação Brasileira de Normas Técnicas (ABNT). [Online]. Available: https://bit.ly/3qqm09z [19] IBSP. (2020) Máscaras n95 – recomenda˜ccões para uso prolongado e reutiliza˜ccão. Instituto Brasileiro Para Segurança Do Paciente. [Online]. Available: https://bit.ly/3Jpfd8D [20] S. Duncan, P.
Bodurtha, and S. Naqvi, “The protective performance of reusable cloth face
masks, disposable procedure masks, KN95 masks and N95 respirators: Filtration
and total inward leakage,” PLoS One, vol. 16, no. 10, p. e0258191, 2021.
[Online]. Available: https://doi.org/10.1371/journal.pone.0258191 [21] C. C.
Ontiveros, D. C. Shoults, S. MacIsaac, K. D. Rauch, C. L. Sweeney, A. K.
Stoddart, and G. A. Gagnon, “Specificity of UV-C LED disinfection efficacy
for three N95 respirators,” Scientific Reports, no. 11, p. 15350, 2021.
[Online]. Available: https://doi.org/10.1038/s41598-021-94810-4 [22] D. B.
Larremore, B. Wilder, E. Lester, S. Shehata, J. M. Burke, J. A. Hay, T.
Milind, M. J. Mina, and R. Parker, “Test sensitivity is secondary to
frequency and turnaround time for covid-19 surveillance,” medRxiv: the
preprint server for health sciences, vol. 20, p. 20136309, Sep 2020.
[Online]. Available: https://dx.doi.org/10.1101/2020.06.22.20136309 [23] CDC. (2020)
Research Use Only 2019-Novel Coronavirus (2019-nCoV) Real-time RT-PCR Primers
and Probes. Centers for Disease Control and Prevention. [Online]. Available:
https://bit.ly/3EBvJyF |
[24] T. I. C. on
Non-Ionizing Radiation Protection, “Guidelines on limits of exposure to
ultraviolet radiation of wavelengths between 180 nm and 400 nm (incoherent
optical radiation),” Health Physics, vol. 87, no. 2, 2004. [Online].
Available: https://doi.org/10.1097/00004032-200408000-00006 [25] M. E. R.
Darnell, K. Subbarao, S. M. Feinstone, and D. R. Taylor, “Inactivation of the
coronavirus that induces severe acute respiratory syndrome, SARS-CoV,” J
Virol Methods, vol. 121, no. 1, pp. 85–91, Oct. 2004. [Online]. Available: https://doi.org/10.1016/j.jviromet.2004.06.006 [26] K. Bedell, A. H. Buchaklian, and S. Perlman, “Efficacy of an automated multiple emitter whole-room ultraviolet-C disinfection system against coronaviruses MHV and MERS-CoV,” Infection Control & Hospital Epidemiology, vol. 37, no. 5, pp. 598–599, 2016. [Online]. Available: https://doi.org/10.1017/ice.2015.348 [27] F. A. Alexandre, J. A. F. Faria, and C. F. Cardoso, “Avaliação
da eficiéncia da radiação ultravioleta na esterilização de embalagens
plásticas,” Ciéncia e Agrotecnologia, vol. 32, no. 5, pp. 1524–1530, 2008. [Online]. Available: https://bit.ly/3mAbDie [28] J. S. Smith, H.
Hanseler, J. Welle, R. Rattray, M. Campbell, T. Brotherton, T. Moudgil, T. F.
Pack, K. Wegmann, S. Jensen, J. Jin, C. B. Bifulco, S. A. Prahl, B. A. Fox,
and N. L. Stucky, “Effect of various decontamination procedures on disposable
N95 mask integrity and SARS-CoV-2 infectivity,” Journal of clinical and
translational science, vol. 5, no. 1, pp. e10–e10, Jun 2020. [Online].
Available: https://dx.doi.org/10.1017/cts.2020.494 [29] M. Biasin, A.
Bianco, G. Pareschi, A. Cavalleri, C. Cavatorta, C. Fenizia, P. Galli, L.
Lessio, M. Lualdi, E. Tombetti, A. Ambrosi, E. M. A. Redaelli, I. Saulle, D.
Trabattoni, A. Zanutta, and M. Clerici, “UV-C irradiationis highly effective
in inactivating SARS-CoV-2 replication,” Scientific Reports, vol. 11, no. 1,
p. 6260, Mar 2021. [Online]. Available: https://doi.org/10.1038/s41598-021-85425-w [30] CDC.
Implementing Filtering Facepiece Respirator (FFR) Reuse, Including Reuse
after Decontamination, When There Are Known Shortages of N95 Respirators.
Centers for Disease Control and Prevention. [Online]. Available: https://bit.ly/3sD9ypQ [31] K. O’Hearn, S.
Gertsman, M. Sampson, R. Webster, A. Tsampalieros, R. Ng, J. Gibson, A. T.
Lobos, N. Acharya, A. Agarwal, S. Boggs, G. Chamberlain, E. Staykov, L.
Sikora, and J. D. McNally, “Decontaminating N95 and SN95 masks with
ultraviolet germicidal irradiation does not impair mask efficacy and safety,”
vol. 106, no. 1, pp. 163–175. [Online]. Available: https://doi.org/10.1016/j.jhin.2020.07.014 [32] L. Liao, W. Xiao, M. Zhao, X. Yu, H. Wang, Q. Wang, S. Chu, and Y. Cui, “Can N95 Respirators Be Reused after Disinfection? How Many Times?” ACS nano, vol. 14, no. 5, pp. 6348–6356, May 2020. [Online]. Available: https://dx.doi.org/10.1021/acsnano.0c03597
|
|
[33] W. G. Lindsley, S. B. Martin Jr., R. E. Thewlis, K. Sarkisian, J. O. Nwoko, K. R. Mead, and J. D. Noti, “Effects of ultraviolet germicidal irradiation (UVGI) on N95 respirator filtration performance and structural integrity,” Journal of Occupational and Environmental Hygiene, vol. 12, no. 8, pp. 509–517, 2015. [Online]. Available: https://doi.org/10.1080/15459624.2015.1018518 [34] ABMT. 87 % das denúncias de falta de EPIs são sobre máscaras
N95, diz AMB. Associação
Brasileira de Medicina do Trabalho. [Online]. Available: https://bit.ly/3JlBFj5 [35] J. Rose. (2020)
Why can’t america make enough N95 masks? 6 months into pandemic, shortages
persist. NPR. SPECIAL SERIES The Coronavirus Crisis. [Online]. Available: https://n.pr/3mBjImT [36] K. Seresirikachorn, V. Phoophiboon, T. Chobarporn, K. Tiankanon, S. Aeumjaturapat, S. Chusakul, and K. Snidvongs, “Decontamination and reuse of surgical masks and N95 filtering facepiece respirators during the COVID-19 pandemic: A systematic review,” Infect Control Hosp Epidemiol, vol. 42, no. 1, pp. 25–30, Jul. 2020. [Online]. Available: https://doi.org/10.1017/ice.2020.379
|
[37] E. C. Toomey, Y. Conway, C. Burton, S. Smith, M. Smalle, X.-H. S. Chan, A. Adisesh, S. Tanveer, L. Ross, I. Thomson, D. Devane, and T. Greenhalgh, “Extended use or reuse of single-use surgical masks and filtering face-piece respirators during the coronavirus disease 2019 (COVID-19) pandemic: A rapid systematic review,” Infect Control Hosp Epidemiol, vol. 42, no. 1, pp. 75–83, Oct. 2020. [Online]. Available: https://doi.org/10.1017/ice.2020.1243 [38] NEVMS, Descontaminação de máscaras de proteção respiratória modelo N95 (respirador particulado). Núcleo de Evidéncia de Mato Grosso do Sul, 2020. [Online]. Available: https://bit.ly/345EmW1 [39] B. K. Heimbuch,
W. H. Wallace, K. Kinney, A. E. Lumley, C.-Y. Wu, M.-H. Woo, and J. Wander,
“A pandemic influenza preparedness study: use of energetic methods to
decontaminate filtering facepiece respirators contaminated with H1N1 aerosols
and droplets,” American Journal of Infectation Control, vol. 39, no. 1, pp.
e1–9, Dec. 2010. [Online]. Available: https://doi.org/10.1016/j.ajic.2010.07.004
[40] S. Sangkham, “Face mask and medical waste disposal during the novel COVID-19 pandemic in Asia,” Case Studies in Chemical and Environmental Engineering, vol. 2, p. 100052, 2020. [Online]. Available: https://doi.org/10.1016/j.cscee.2020.100052 |